Proteins: Nature’s Own Nano-Machines
Di sadur Oleh : Mega Sirnawati M.Pd
1. PENTINGNYA PROTEIN
Untuk kebanyakan orang, "protein" berkaitan dengan nutrisi atau latihan. Bahkan, protein yang paling fungsional-beragam molekul dalam organisme hidup. Berikut adalah beberapa contoh dari fungsi yang paling umum dari protein:
1. Enzim
Dalam setiap sel dari setiap makhluk hidup ada ribuan reaksi kimia yang terjadi pada waktu yang sama. Reaksi-reaksi memungkinkan sel untuk mengekstrak energi dari bahan makanan, membangun bahan kompleks, kerusakan limbah beracun, mensintesis kelompok besar molekul biologis aktif, dan banyak lagi. Sebagian besar reaksi terjadi dengan mudah, tetapi sangat lambat (sampai ribuan tahun!). Hal ini berbeda dengan kebutuhan seluler, yang memerlukan reaksi terjadi dalam skala waktu nanodetik untuk milidetik untuk mempertahankan hidup. Dengan demikian, hampir semua reaksi biologis dikatalisis, yaitu dipercepat oleh katalis. Dalam reaksi katalisis dasarnya dapat dilakukan oleh logam sederhana. Namun, elemen-elemen sederhana mempercepat reaksi non-spesifik. Artinya, mereka bisa membantu mengubah reaktan menjadi produk yang berbeda dari yang dimaksudkan, serta berfungsi sebagai katalis dalam reaksi yang melibatkan reaktan lainnya. Juga, tingkat percepatan tidak dapat dipengaruhi atau diatur dalam kasus katalis logam sederhana. Beberapa protein, enzim disebut, mampu bertindak sebagai katalis dari reaksi kimia. Namun, berbeda dengan katalis logam sederhana, enzim mempercepat reaksi dengan cara yang sangat spesifik dan juga dapat diatur secara efisien. Untuk alasan ini, protein telah dipilih oleh evolusi sebagai katalis prinsip dalam semua organisme biologis. Katalisis sangat spesifik diterapkan oleh enzim memungkinkan ribuan reaksi kimia dalam setiap sel terjadi tanpa salah satu dari mereka mengganggu yang lain. Selain itu, sel-sel mengatur tingkat enzim mereka dengan cara yang berbeda, terutama dengan menggunakan molekul kecil yang mengikat enzim dan baik menambah atau mengurangi aktivitas mereka (aktivator dan inhibitor, masing-masing).
Sebuah animasi sederhana yang menunjukkan bagaimana enzim (bentuk kuning) mempercepat reaksi kimia yang memecah molekul reaktan menjadi dua molekul produk (source)
Berikut ini adalah animasi menunjukkan aksi enzim.
Untuk kebanyakan orang, "protein" berkaitan dengan nutrisi atau latihan. Bahkan, protein yang paling fungsional-beragam molekul dalam organisme hidup. Berikut adalah beberapa contoh dari fungsi yang paling umum dari protein:
1. Enzim
Dalam setiap sel dari setiap makhluk hidup ada ribuan reaksi kimia yang terjadi pada waktu yang sama. Reaksi-reaksi memungkinkan sel untuk mengekstrak energi dari bahan makanan, membangun bahan kompleks, kerusakan limbah beracun, mensintesis kelompok besar molekul biologis aktif, dan banyak lagi. Sebagian besar reaksi terjadi dengan mudah, tetapi sangat lambat (sampai ribuan tahun!). Hal ini berbeda dengan kebutuhan seluler, yang memerlukan reaksi terjadi dalam skala waktu nanodetik untuk milidetik untuk mempertahankan hidup. Dengan demikian, hampir semua reaksi biologis dikatalisis, yaitu dipercepat oleh katalis. Dalam reaksi katalisis dasarnya dapat dilakukan oleh logam sederhana. Namun, elemen-elemen sederhana mempercepat reaksi non-spesifik. Artinya, mereka bisa membantu mengubah reaktan menjadi produk yang berbeda dari yang dimaksudkan, serta berfungsi sebagai katalis dalam reaksi yang melibatkan reaktan lainnya. Juga, tingkat percepatan tidak dapat dipengaruhi atau diatur dalam kasus katalis logam sederhana. Beberapa protein, enzim disebut, mampu bertindak sebagai katalis dari reaksi kimia. Namun, berbeda dengan katalis logam sederhana, enzim mempercepat reaksi dengan cara yang sangat spesifik dan juga dapat diatur secara efisien. Untuk alasan ini, protein telah dipilih oleh evolusi sebagai katalis prinsip dalam semua organisme biologis. Katalisis sangat spesifik diterapkan oleh enzim memungkinkan ribuan reaksi kimia dalam setiap sel terjadi tanpa salah satu dari mereka mengganggu yang lain. Selain itu, sel-sel mengatur tingkat enzim mereka dengan cara yang berbeda, terutama dengan menggunakan molekul kecil yang mengikat enzim dan baik menambah atau mengurangi aktivitas mereka (aktivator dan inhibitor, masing-masing).
Sebuah animasi sederhana yang menunjukkan bagaimana enzim (bentuk kuning) mempercepat reaksi kimia yang memecah molekul reaktan menjadi dua molekul produk (source)
Berikut ini adalah animasi menunjukkan aksi enzim.
2. Permukaan sel-Reseptor
Banyak protein yang berada di / dalam membran sel sel yang terlibat dalam sel-sel sinyal. Protein ini tahu bagaimana mengikat molekul utusan yang datang dari sel-sel lain, mengikat mereka, dan relay pesan mereka ke dalam sel. Hasil pesan tersebut mungkin sintesis molekul tertentu, pertumbuhan atau pembagian sel, dan bahkan bunuh diri sel (misalnya ketika telah terinfeksi virus). Reseptor protein Beberapa, seperti yang menanggapi utusan steroid, berada di dalam sel lebih pada permukaannya. Setelah molekul kurir kognitif mereka telah memasuki sel dan melekat pada mereka, ini recptors protein membantu mengikat secara khusus untuk elemen genetik dalam DNA nuklir sel. Ini perubahan ekspresi gen dalam sel, yang sering menyebabkan berumur panjang perubahan. Lebih lanjut mengenai sinyal selular dan reseptor dapat ditemukan di sini.
Permukaan sel reseptor jenis yang berbeda (sumber)
3. Kimia Messenger
Segmen protein pendek tertentu, peptida disebut, bertindak sebagai utusan kimia yang mengikat reseptor permukaan sel dan menginduksi berbagai perubahan dalam perilaku selular. Misalnya, vasopressin disebut peptida dikeluarkan dari sel dalam kelenjar pituitari hewan mengikuti dehidrasi atau kehilangan darah, dan mempengaruhi sel-sel yang berbeda dalam tubuh. Efeknya pada sel ginjal menurun kehilangan air selama pembentukan urin, sedangkan efeknya pada sel-sel otot polos arteri sekitar menyebabkan kontraksi mereka dan, sebagai akibatnya, peningkatan tekanan darah.
Struktur atom dari vasopressin (source)
4. Transportasi Protein
Beberapa protein tertanam dalam membran plasma sel memungkinkan masuk dan / atau keluar dari molekul yang berbeda dengan cara yang sangat diatur. Protein ini karena mengontrol komposisi kimia dari sel. Beberapa protein transpor yang berbentuk sebagai saluran sempit dan fungsi dalam transportasi ion kecil dalam dan keluar dari sel. Lainnya, memiliki struktur yang lebih kompleks, mengangkut molekul besar seperti gula dan asam amino. Ini disebut 'operator'. Sementara saluran protein hanya dapat mengangkut ion ke elektro-kimia gradien mereka ('transpor pasif'), beberapa operator mampu mengangkut atom / molekul up gradien mereka (lihat gambar di bawah). Transporter ini disebut 'pompa', dan aktivitas transportasi mereka disebut 'transpor aktif', karena membutuhkan energi. Energi yang mungkin diberikan langsung oleh mogok ATP, atau tidak langsung, dengan kopling energi yang dilepaskan dari transportasi dari atom kedua / molekul bawah gradien, untuk proses transportasi energi yang membutuhkan. Lebih lanjut mengenai transporter selular dapat ditemukan di sini.
Aktif vs pasif transportasi zat terlarut (source)
5. Struktural Elemen
Tidak seperti enzim, reseptor dan transporter, beberapa protein memainkan peran lebih pasif, sebagai blok bangunan struktur yang jauh lebih besar di dalam dan di luar sel. Yang paling penting dari struktur ini sitoskeleton, yang berada di pinggiran bagian dalam sel, dan matriks ekstra-seluler, yang berada di luar sel.
Sitoskeleton (helai kuning & biru) memanjang dari inti sel (bola merah muda) ke pinggiran sel (sumber)
Menjadi begitu fungsional beragam, protein memainkan peran sentral dalam hampir semua proses fisiologis. Ini termasuk pelaksanaan rencana genetik tubuh kita, mempertahankan tubuh kita terhadap bakteri, virus, dan racun, mengangkut oksigen, memfasilitasi komunikasi hormonal dan saraf, menjaga tekanan darah stabil, dan membangun sel-sel dan jaringan.
Oleh karena itu, ketika protein yang rusak akibat mutasi, agen infeksi, atau racun, hal ini dapat menyebabkan penyakit serius. Misalnya, p53 protein diaktifkan ketika DNA kita dirugikan oleh radiasi. p53 mencegah sel dari membagi sampai DNA yang rusak diperbaiki. Ketika p53 sendiri rusak, sel biasanya menjadi kanker. Bahkan, sekitar 50% dari tumor mengandung p53 rusak. Hal ini tidak mengherankan kemudian, bahwa sebagian besar target molekul utama obat resep adalah protein. Misalnya, obat penghilang rasa sakit terkenal dan demam-mengurangi Ibuprofen obat:
Ibuprofen (serta anggota lain dari keluarga Non-steroid Anti-inflamasi Obat) bekerja dengan cara menetralkan protein-enzim yang disebut COX, yang menghasilkan rasa sakit dan demam-bahan kimia penyebab dalam tubuh kita. Gambar di bawah ini menunjukkan struktur COX (merah-hijau-abu pita) terikat untuk ibuprofen (bola):
*
Protein juga ditargetkan oleh penyalahgunaan obat. Sebagai contoh, obat narkotika heroin (sintetis meniru dari opium yang diturunkan morfin) bertindak dengan mengikat reseptor protein di otak, yang biasanya merespon obat penghilang rasa sakit alami tubuh kita, endorfin. Dengan cara ini, obat menginduksi euforia dan sensasi nyeri berkurang. Namun, berbeda dengan endorfin alami, heroin sangat adiktif dan merugikan tubuh kita.
2. FUNGSI PROTEIN MELIBATKAN MENGIKAT
Obat tidak hanya molekul yang dapat mengikat protein. Bahkan, hampir semua fungsi protein meminta mereka untuk mengikat molekul lain. Ini disebut "ligan" pada umumnya. Ligan secara fungsional beragam: mereka dapat bertindak sebagai substrat protein (enzim), regulator yang dilepaskan oleh sel untuk mempercepat atau memperlambat aktivitas protein, sebagai utusan kimia (misalnya hormon), dan banyak lagi. Ligan juga sangat beragam kimia: mereka mungkin molekul organik kecil, lipid, gula, DNA, dan bahkan protein dan peptida.
Protein mengikat ligan mereka menggunakan indentasi saku seperti pada permukaannya, yang disebut "situs mengikat" atau "situs aktif" (ketika saku juga merupakan situs dimana katalisis enzimatik terjadi). Protein situs mengikat datang dalam berbagai bentuk dan komposisi kimia, untuk mencocokkan keragaman ligan. Misalnya, jika ligan adalah molekul kecil, situs pengikatan akan menjadi kecil dan sempit, sedangkan situs mengikat untuk ligan yang itu sendiri protein sering besar dan datar. Gambar di bawah ini menunjukkan pertandingan geometrik dan kimia dari enzim metabolik (LDH) situs aktif dan ligan:
* (Klik pada gambar untuk melihat animasi)
Pertandingan antara situs protein yang mengikat dan hasil ligan dari kemampuan protein untuk posisi kelompok kimia tertentu di sekitar ligan pada jarak tertentu dan sudut (lihat gambar di bawah). Kelompok-kelompok ini berinteraksi dengan atom ligan, sehingga membuatnya tetap terikat pada protein. Dalam enzim, kelompok bahan kimia yang berinteraksi dengan ligan (disebut di sini 'substrat') juga bertindak kimia di atasnya, yang menginduksi katalisis substrat menjadi produk (yaitu molekul yang berbeda). Seperti yang akan dijelaskan di bawah ini, posisi semua kelompok kimia kunci dalam protein ditentukan oleh struktur 3D-nya.
Fisik interaksi antara ligan (hijau) dan kelompok bahan kimia di situs aktif enzim.
3. STRUKTUR PROTEIN IS KOMPLEKS
Asam amino dan ikatan peptida
(Untuk rincian lebih lanjut tentang asam amino, lihat bagian berikut)
(Untuk rincian lebih lanjut tentang asam amino, lihat bagian berikut)
Protein adalah polimer panjang asam amino, yang semuanya memiliki struktur kimia yang sama secara umum:
Struktur umum dari asam amino.
Ada 20 jenis asam amino alami, masing-masing memiliki sisi unik-chain (R group):
The 20 jenis asam amino. Rantai samping yang ditandai dengan persegi panjang merah muda. (Diambil dari buku biokimia Lehninger s)
The 20 jenis asam amino. Rantai samping yang ditandai dengan persegi panjang merah muda. (Diambil dari buku biokimia Lehninger s)
Beberapa protein juga mengandung turunan asam amino (alias 'non-alami asam amino'). Sebagai contoh, kolagen, protein yang tersebar luas di jaringan ikat hewan, mengandung hydroxyproline dan hidroksilin. Ini diproduksi oleh lampiran kelompok hidroksil pada asam amino prolin dan lisin alami, masing-masing. Lain asam amino non-alami, γ-carboxyglutamate, dibentuk oleh lampiran kelompok karboksil ke glutamat asam amino dalam darah-pembekuan protein. Semua yang disebutkan di atas turunan asam amino diciptakan enzimatik, setelah protein terbentuk. Namun, ada setidaknya dua dikenal non-alami asam amino, selenocysteine dan pyrrolysine, yang dibuat sebelumnya dan diintegrasikan ke dalam protein pembentuk.
Beberapa non-alami asam amino
Bagaimana protein matang terbentuk dari asam amino bebas? - Rencana pembentukan protein setiap dikodekan oleh gen tertentu dalam DNA sel. Sel memiliki mesin yang kompleks yang menyatukan asam amino individu dan menempel mereka satu sama lain dalam urutan tertentu yang ditentukan oleh gen yang sesuai. Asam amino terpasang membentuk rantai panjang, yang disebut 'polipeptida'. Mengikat dilakukan melalui pembentukan ikatan peptida:
Urutan asam amino sepanjang polipeptida disebut 'struktur primer' dari protein.
Lipatan 3D dari protein: struktur sekunder dan tersier
Meskipun masing-masing asam amino memiliki sisi yang berbeda-rantai dengan sifat kimia yang unik, ada beberapa kesamaan. Sebagai contoh, beberapa asam amino rantai samping hidrofilik, yaitu suka dikelilingi oleh air. Lain sisi-rantai yang hidrofobik, yaitu benci dikelilingi oleh air. Dalam rantai polipeptida, rantai asam amino hidrofilik samping yang elektrostatis tertarik satu sama lain ('mencari sama sama'). Demikian pula, sisi rantai asam amino hidrofobik tertarik satu sama lain dan ditolak oleh rantai samping asam amino hidrofilik. Hal ini menciptakan sebuah kekuatan fisik yang mendorong rantai protein linier untuk melipat, sehingga memungkinkan asam amino karena banyak dari jenis yang sama mungkin untuk menjadi dekat satu sama lain :
(klik : http://www.youtube.com/watch?v=swEc_sUVz5I)
Lipat dari rantai (polipeptida) protein. Lipat ini memungkinkan asam amino hidrofobik (bola hijau) meringkuk bersama-sama dalam inti protein, sedangkan asam amino hidrofilik (bola merah muda) membentuk permukaan air diakses dari protein. Molekul air melanda protein baik dilipat dan dilipat juga ditampilkan.
Dalam kebanyakan protein intraseluler (sitoplasma) atau ekstraseluler, proses lipat menciptakan bentuk globular, di mana asam amino hidrofobik dimakamkan pada intinya, jauh dari air, sedangkan sebagian besar asam amino hidrofilik berada di permukaan, berinteraksi positif dengan berair sekitarnya dan dengan satu sama lain:
Permukaan (abu-abu) vs inti (cyan) residu dalam protein yang larut dalam air.
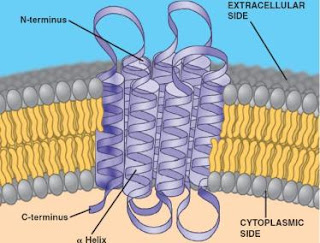
Protein yang berada di dalam membran selular juga globular, namun asam amino yang paling hidrofobik mereka berada di permukaan mereka, di mana mereka dapat berinteraksi positif dengan lipid hidrofobik membran:
Integral membran protein. Rantai protein melintasi inti hidrofobik membran beberapa kali. Akibatnya, bagian lipid terpajan protein juga harus sangat hidrofobik.
Jika kita melihat dari dekat protein globular, kita akan melihat bahwa di sebagian besar dari mereka rantai polipeptida membentuk struktur lokal seperti mata air (alpha-heliks) dan bentuk diperpanjang (beta-helai). Ini disebut 'struktur sekunder'. Bagian-bagian dari rantai yang menghubungkan struktur sekunder biasanya teratur (loop). Dalam air-larut protein pola struktur sekunder cukup beragam (lihat di bawah), sedangkan pada membran-terikat protein mereka lebih sederhana karena kendala diterapkan oleh lipid sekitarnya.
Sekunder struktur rantai protein utama. Alpha-heliks dalam merah dan beta-helai yang berwarna kuning.
Organisasi secara keseluruhan dari semua struktur lokal dan loop dalam protein menciptakan bentuk dilipat 3D, yang disebut 'struktur tersier'.
Tidak semua protein globular. Beberapa protein, terutama yang berada dalam matriks ekstraselular dikatakan berserat karena mereka memiliki bentuk memanjang dan diatur sebagai serat. Ini termasuk, misalnya, kolagen, yang merupakan protein prinsip dalam jaringan ikat hewan:
Tidak semua protein globular. Beberapa protein, terutama yang berada dalam matriks ekstraselular dikatakan berserat karena mereka memiliki bentuk memanjang dan diatur sebagai serat. Ini termasuk, misalnya, kolagen, yang merupakan protein prinsip dalam jaringan ikat hewan:
Struktur berserat kolagen
Protein berserat juga mengandung tiga tingkat struktur. Namun, mereka tersier (3D) struktur biasanya sederhana dan terdiri dari pola berulang dari elemen struktur tunggal sekunder. Tingkat struktur yang disebut sebagai 'super-struktur sekunder'. Misalnya, protein berserat alpha-keratin, yang membangun rambut dan kuku, terdiri dari dua alpha-heliks rantai polipeptida. Ini luka di sekitar satu sama lain dalam bentuk yang disebut 'melingkar coil':
Struktur melingkar-coil alpha-keratin
Chains datang bersama-sama: struktur kuaterner
Akhirnya, banyak protein cenderung untuk memasukkan lebih dari satu rantai polipeptida. Rantai yang berbeda berinteraksi satu sama lain non-kovalen dan bentuk apa yang disebut sebagai 'struktur kuaterner'. Yang bergabung dengan rantai polipeptida dalam protein tersebut diperlukan untuk fungsi mereka. Sebuah contoh yang terkenal untuk protein memiliki struktur kuaterner adalah hemoglobin, protein yang mentransfer oksigen dari paru-paru ke seluruh jaringan lainnya, sehingga memungkinkan mereka untuk napas. Hemoglobin memiliki struktur kuaterner yang meliputi empat rantai polipeptida:
Struktur kuaterner hemoglobin. Setiap rantai polipeptida yang terdiri dari struktur keseluruhan berada dalam warna yang berbeda, masing-masing termasuk 'heme', oksigen-mengikat co-factor (ditampilkan sebagai tongkat).
4. FUNGSI PROTEIN DITENTUKAN OLEH STRUKTUR PERUSAHAAN
Sebagaimana disebutkan di atas, hasil fungsi protein dari kemampuannya untuk mengikat ligan kognitif, dan dalam kasus enzim menginduksi katalisis. Keduanya memerlukan pembentukan sebuah situs pengikatan / aktif dalam protein, di mana ligan ini dikelilingi oleh kelompok-kelompok kimia yang secara fisik berinteraksi dengan itu dan (dalam kasus enzim) bertindak kimiawi di atasnya. Kelompok-kelompok kimia fungsional penting adalah rantai samping (dan rantai tingkat yang lebih rendah utama) atom protein, dan posisi hati mereka di sekitar ligan adalah akibat langsung dari lipatan 3D spesifik dari protein. Ini menunjukkan paradigma sentral dalam makro-molekul: Struktur menentukan fungsinya.
Kita telah melihat bahwa protein lipat karena daya tarik fisik antara asam amino mereka sisi-rantai. Pola tarik tertentu tergantung pada urutan yang unik dari protein. Oleh karena itu, lipatan 3D yang unik dari protein tergantung pada urutannya. Dengan kata lain, informasi untuk struktur spesifik dari protein, yang pada gilirannya menentukan fungsi mereka, dikodekan dalam urutan sederhana asam amino di sepanjang rantai! Ini "Urutan menentukan struktur, dan karena itu fungsi" realisasi datang lebih dari 30 tahun yang lalu berkat eksperimen terkenal Christian Anfinsen. Dalam percobaan ini, Anfinsen terganggu struktur 3D enzim terisolasi yang disebut ribonuklease dengan menggunakan bahan kimia. Ketika bahan kimia tersebut telah dihapus, protein kembali struktur 3D dan fungsi enzimatik. Hal ini terjadi meskipun fakta bahwa protein diisolasi dalam tabung reaksi dan tidak ada bantuan dari molekul lain yang mungkin berada di dalam lingkungan alam selular. Kesimpulan yang tak terhindarkan itu, karena itu, bahwa semua informasi untuk lipat sudah ada di sana, yaitu, dikodekan dalam urutan protein.
5. STRUKTUR PROTEIN DAPAT DITENTUKAN ATAU DIPERKIRAKAN
Kesadaran bahwa struktur dan fungsi yang erat terhubung dalam protein adalah dasar untuk bidang yang berbeda dalam ilmu biologi disebut "biologi struktural". Ahli biologi struktural mempelajari struktur protein dan molekul besar lainnya, untuk memahami faktor-faktor yang tepat yang menentukan fungsi mereka. Langkah pertama dalam mempelajari protein baru menggunakan pendekatan ini adalah menentukan struktur 3D-nya. Ini bukan tugas yang sederhana, dan membutuhkan alat yang sangat mahal dan kompleks, jangka waktu pekerjaan, dan banyak kesabaran. Dalam beberapa kasus, struktur dapat diprediksi (untuk tingkat tertentu akurasi) dengan metode komputasi. Ada dua pendekatan komputasi dasar untuk menentukan aspek struktural protein. Yang pertama mencoba untuk menemukan kemiripan antara urutan protein dengan protein dengan struktur 3D dikenal. Ini bergantung pada "urutan menentukan struktur" paradigma dijelaskan di atas. Jika protein baru memiliki urutan sangat mirip dengan yang lama (dengan struktur yang dikenal), maka diasumsikan mereka memiliki struktur yang sangat mirip. Pendekatan ini disebut "homologi modeling". Ini adalah alat yang ampuh untuk prediksi struktur, dan akurasi yang meningkat dengan jumlah struktur 3D dikenal. Untuk membuatnya bekerja, urutan protein yang tidak diketahui biasanya harus dibandingkan dengan lebih dari satu protein urutan dengan struktur yang dikenal (beberapa sequence aligment). Manfaat prosedur ini dari wawasan manusia, dan pemodelan karena itu baik biasanya dilakukan oleh peneliti yang berpengalaman. Namun, beberapa alat otomatis untuk pemodelan homologi memang ada (Model Swiss misalnya).
Pendekatan komputasi kedua disebut "biofisik", karena hal itu bergantung pada sifat fisika-kimia dari semua asam amino membangun rantai protein, untuk menghitung interaksi mereka satu sama lain, dan (berdasarkan itu) memprediksi jalur lipat dari rantai. Perhitungan yang terlibat dalam pendekatan ini menuntut komputasi, dan sebagai hasilnya, mereka dalam memprediksi lipat secara akurat sangat terbatas. Namun, dengan meningkatnya pertumbuhan daya komputasi, kekuatan prediktif dari pendekatan ini diharapkan meningkat juga. Mungkin keuntungan terbesar dari pendekatan biofisik adalah ketergantungan pada prinsip-prinsip fisik dasar. Ini endows dengan dua kemampuan. Pertama, itu adalah independen dari data dari sumber lain, seperti urutan dan struktur protein yang sudah dikenal. Kedua, dapat digunakan untuk mempelajari aspek-aspek penting lainnya dari protein, selain memprediksi struktur mereka. Misalnya, hubungan struktur-fungsi dalam protein dapat dipelajari dengan menghitung ciri-ciri fisik kunci ditentukan oleh distribusi 3D atom protein dan pada gilirannya mempengaruhi fungsi protein.
**
6. PROTEIN ADALAH ENTITAS DYNAMIC
Salah satu fitur tersebut adalah dinamika. Meskipun protein lipat ke konformasi tertentu (disebut "negara asli"), struktur ini masih jauh dari statis. Atom dalam protein bergerak dan bergetar terus-menerus, sebagai akibat dari energi panas di lingkungan mereka, dikonversi oleh protein menjadi energi kinetik. Animasi di bawah ini menunjukkan perubahan konformasi protein, dicatat oleh teknik laboratorium biofisik yang disebut "NMR":
(Klik pada gambar untuk melihat animasi)
Banyak penelitian telah menunjukkan dinamika menjadi sangat penting untuk fungsi protein. Sebagai contoh, pengikatan satu molekul oksigen ke hemoglobin sel darah merah protein menginduksi perubahan konformasi protein yang membuatnya lebih mudah bagi molekul oksigen tambahan untuk mengikat. Fenomena ini disebut "allostery", dan juga mekanisme di mana regulasi enzim oleh metabolit selular kecil didasarkan pada; pengikatan metabolit menginduksi perubahan konformasi enzim, yang mengubah fungsinya. Menariknya, protein mempertahankan dinamika mereka bahkan tanpa adanya molekul mengatur, Tampaknya bahwa regulator hanya memodulasi perubahan dinamis alami dan cara ini juga mengaktifkan atau menghambat protein. Animasi di bawah ini menunjukkan pergeseran menyela antara dua konformasi enzim eksperimen-ditentukan, satu yang aktif dan yang kedua adalah tidak aktif:
(Klik pada gambar untuk melihat animasi).
Perhatikan molekul inhibitor di sisi kiri atas gambar. Molekul ini muncul terikat satu konformasi saja (yang aktif), yang sesuai dengan geometri dan sehingga memungkinkan untuk mengikat. Sekali lagi, pergeseran antara dua konformasi spontan, tetapi pengikatan inhibitor ke konformasi aktif stabil dan memperpanjang waktu yang menghabiskan protein dalam konformasi ini.
Diadopsi dari : Introduction to Proteins: Structure, Function, and Motion (Chapman & Hall/CRC Mathematical & Computational Biology)






















Tidak ada komentar:
Posting Komentar